Референтное государство — это страна
Заявитель имеет право выбрать любую страну из ЕАЭС в качестве референтного государства: Россию, Беларусь, Казахстан, Армению, Киргизию. Но выбрать можно только одну страну. Например, если запускать процедуру регистрации в России, то референтным государством будет считаться Россия, а Росздравнадзор, как экспертная организация, будет осуществлять регистрацию медизделия.
Государство признания — это страна ЕАЭС, чья экспертная организация согласовывает результаты экспертизы референтного государства и допускает медизделие к реализации на своей территории.
Например, если экспертиза проводится в России, как в референтной стране, то в качестве страны признания можно выбрать: Казахстан, Беларусь, Армению, Киргизию, можно и сразу несколько стран ЕАЭС, смотря чей рынок интересует производителя или дистрибьютора. Выбранные страны признания подключаются к процедуре регистрации на этапе согласования проведенной экспертизы. Если они одобряют результаты, то производитель получает доступ к их рынку.
В статье разберем новую процедуру выбора референтного государства и государств признания, а также на какие нюансы обратить внимание.
Содержание
Почему ввели эти понятия
Пнациональным правилам таких понятий, как «государство признания» или «референтное государство» не существовало. Эти два термина появились в новых правилах ЕАЭС.
Одна из целей Евразийского экономического союза — это общий рынок обращения медицинских изделий с единой для всех процедурой регистрации. В ЕАЭС входят Россия, Беларусь, Армения, Казахстан и Киргизия. Если раньше производители проходили отдельную регистрацию в каждом государстве, то теперь достаточно пройти регистрацию в одном государстве, а для доступа к рынку других стран ЕАЭС достаточно получить от них согласование результатов экспертизы.
Представим ситуацию, производитель из России хочет зарегистрировать новое медизделие в России, Казахстане и Беларуси. По национальным правилам ему предстоит пройти процедуру регистрации отдельно в каждой стране. По правилам ЕАЭС регистрация будет проходить в одной стране союза, например России, а для выхода на рынок Казахстана и Беларуси, производитель указывает их в качестве «государств признания». Таким образом, основная часть регистрации проходит в России, а на заключительных этапах, Казахстан и Беларусь согласовывают проведенную экспертизу и тем самым дают разрешение на реализацию изделий на своей территории.
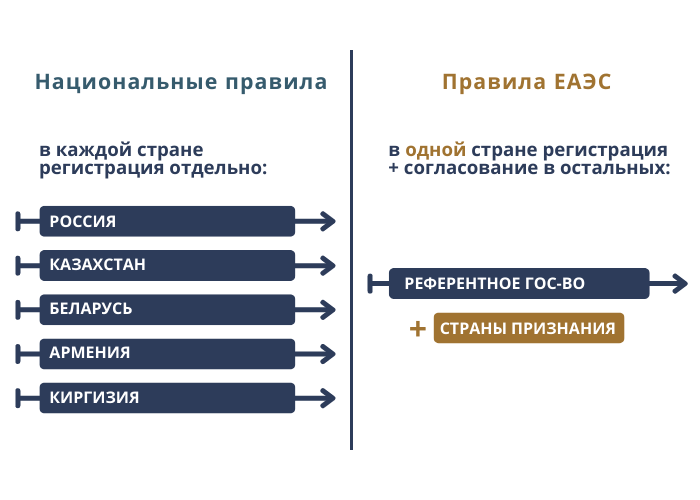
Получается, что два новых термина позволяют разграничить статус стран-участниц ЕАЭС при регистрации изделия. Одна страна ведущая - референтная, вторая согласующая - признания. Разберем ниже, как устроена процедура выбора референтного гос-ва и стран признания.
Как устроена процедура
По регламенту всё очень просто: заявитель выбирает одну страну в качестве референтного гос-ва, также одну или несколько стран признания. Выбранные страны указываются в заявлении на регистрацию. Если представить этапы регистрации, то это самое начало всей процедуры:
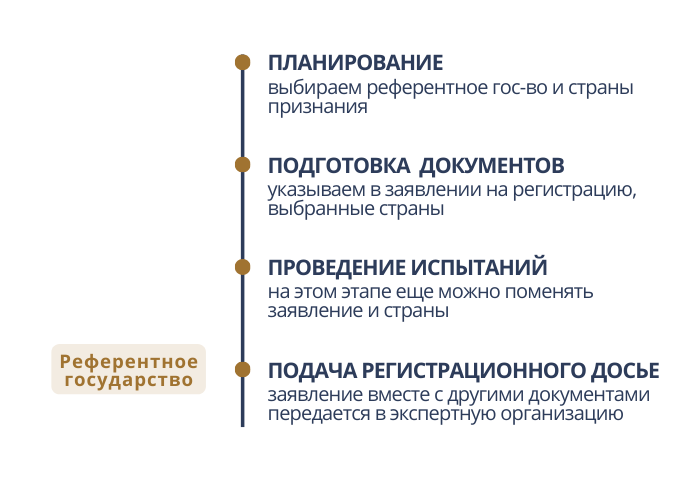
В теории все легко, но на практике правильный выбор стран играет немалую роль. Производителю и дистрибьютору предстоит принять стратегически важное решение. До момента подачи регистрационного досье в экспертную организацию референтного государства технически еще можно поменять страны. Достаточно вписать в заявление другие. Но на практике определиться лучше заранее, чтобы не переводить на другой язык разработанные заранее документы, например, этикетки, инструкции.
Дальше основная часть регистрации будет проходить в экспертной организации выбранного референтного государства. Вот список самих экспертных организаций:
- Федеральная служба по надзору в сфере здравоохранения в России
- Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники в Казахстане
- Центр экспертиз и испытаний в здравоохранении Министерства здравоохранения Республики Беларусь
- Министерство здравоохранения Кыргызской Республики
- Научный центр экспертизы лекарств и медицинских технологий в Армении
После проведенной экспертизы качества, безопасности и эффективности медицинского изделия заявитель оплачивает госпошлины. Размер госпошлин в государствах признания:
Россия (Руб):
1 класса — 72 000
2а класса — 104 000
2б класса — 136 000
3 класса — 184 000
Беларусь (USD):
1 класса — 866
2а класса — 1 491
2б класса — 1 665
3 класса — 1 674
Киргизия (Сом):
1 класса — 28 124
2а класса — 42 028
2б класса — 56 248
3 класса — 70 152
Казахстан (Тенге):
1 класса — 345335.20
2а класса — 398003.20
2б класса — 444559.36
3 класса — 512085.28
Армения (Драм)
Официально пока еще не установлены
После оплаты госпошлин экспертная организация референтного гос-ва размещает Заключение экспертизы в информационной системе для его согласования государствами признания. Государства признания должны направить подтверждение согласования (или несогласования) Заключения экспертизы с обоснованием. В течение 30 календарных дней Росздравнадзор ожидает ответа от государств признания, после чего переходит к принятию решения о регистрации медицинского изделия.
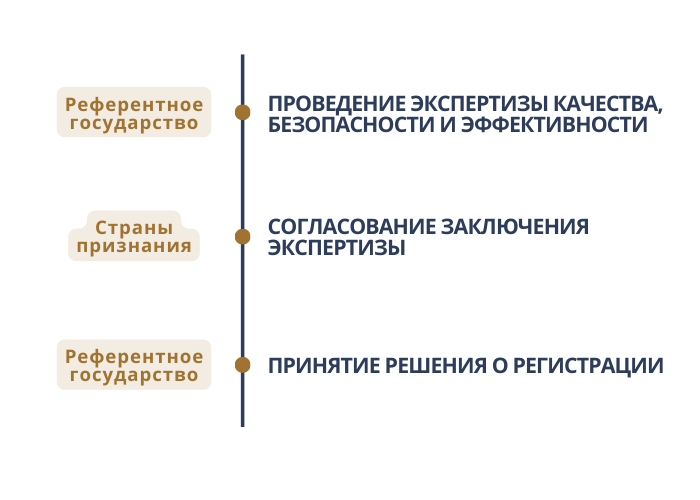
Полная версия порядка регистрации по ЕАЭС
Некоторые нюансы, касающиеся других этапов регистрации:
- Испытания медицинских изделий можно проводить в любом государстве ЕАЭС, даже если оно не заявляется ни как референтное, ни как государство признания.
- Инспекция производства при регистрации может проводиться только в референтном государстве. Последующие плановые инспекции проводит инспектирующая организация на выбор заявителя.
Как выбрать референтное государство
Референтное государство — страна, в которой проходит регистрация медицинского изделия. Как правило, в качестве референтной страны выбирают государство, где юридически зарегистрирована сама компания. Например, если производитель из России, то в качестве референтного государства можно указать Россию, не важно где его производственные площадки. Но это не значит, что нельзя выбрать любую другую страну ЕАЭС в качестве референтной, но уже тогда компания будет иметь статус иностранной. Поэтому полезно учитывать все факторы: налоговую нагрузку в разных странах ЕАЭС, приоритетность рынка для компании, юридические и правовые особенности. На практике у производителя или дистрибьютора в родной стране больше понимания как и что работает, не говоря уже об экономии на нотариальных переводах или курьерских службах.
Окончательное решение всегда за заявителем, мы можем только подсказать, на что обратить внимание:
- приоритетность рынка
- понимание юридических особенностей
- налоговая нагрузка
Остальные страны можно указать в качестве государств признания, что, в случае успеха процедуры регистрации, откроет доступ к их рынку.
Как выбрать государство признания
Государство признания — страна, которая согласовывает результаты экспертизы референтного государства. В случае с выбором государств признания вопрос аналогично стратегический. Чей рынок медизделий интересует? Выбор оставляем за компанией, но попробуем подсказать на что обратить внимание.
Важно помнить, что в каждой стране признания предстоит оплачивать госпошлину, а это расходы. Также по регламенту нужно указать минимум одну страну признания. Например, Россия (референтное государство), а Казахстан (страна признания). Даже если интересует рынок только одного государства, по правилам ЕАЭС нельзя обойтись без выбора стран признания.
Другая ситуация, когда страна признания выбрана, но она не согласовала заключение экспертизы от референтного государства, а само референтное государство приняло положительное решение. Тогда выданное регистрационное удостоверение будет действовать только на территории референтного государства.
Если у вас остались вопросы по данной теме, то обращайтесь за консультацией к нашим экспертам.





